
Bioactive Materials: 基于二维锑烯的复合纳米药物通过逆转细胞热抵抗增强肿瘤低温热疗
文章标题:2D antimonene-integrated composite nanomedicine for augmented low-temperature photonic tumor hyperthermia by reversing cell thermoresistance
第一作者:Jianrong Wu and Xiaojun Cai
通讯作者:Bing Hu,Yu Chen, and Yuanyi Zheng
通讯单位:上海交通大学附属第六人民医院,上海大学
论文导读:
光热治疗(PTT)的临床转化仍存在一些不可避免的局限性。例如,肿瘤部位诱导的局部高温和非特异性热扩散会对周围健康组织造成损伤。此外,肿瘤深部热量不足可能导致肿瘤复发和转移。此外,肿瘤细胞固有的热抵抗性也是一个关键的科学问题。基于此,上海交通大学附属第六人民医院郑元义教授、胡兵教授和上海大学陈雨教授等将通过整合碳酸钙(CaCO3)和锑烯量子点(AQDs),构建一种“无抑制剂参与”纳米系统,用于肿瘤低温光热治疗。CaCO3纳米颗粒被用作纳米载体负载AQDs和葡萄糖氧化酶(GOD),同时在表面进行PEG化制备pH响应的纳米催化剂(G/A@CaCO3-PEG),借此探索该纳米催化剂用于增强低温PTT的可行性(图一)。本章采用气体扩散法合成CaCO3纳米颗粒,并将其作为模板,通过一步共沉淀法制备G/A@ CaCO3。制备的G/A@ CaCO3纳米催化剂可以在肿瘤微环境的微酸性pH下快速降解,导致负载的GOD和AQDs的释放。AQDs可以有效地将近红外激光辐照转化为局部高热实现PTT。同时,同时,释放的GOD催化葡萄糖的氧化。这一葡萄糖消耗过程可以限制ATP的供应,从而导致HSP的下调,因此降低了肿瘤细胞的耐热性。此外,基于AQDs强的近红外区吸收,构建的G/A@CaCO3纳米催化剂可作为PA成像的造影剂。我们分别在体外细胞水平和体内SW1990荷瘤小鼠模型上系统地研究了这种PA成像引导下的光热治疗效果。
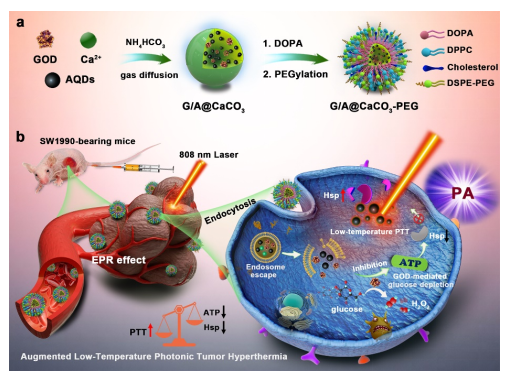
图一 (a)G/A@ CaCO3-PEG纳米催化剂的构建和(b)其治疗过程和机制示意图。该纳米催化剂基于CaCO3纳米颗粒,共封装AQDs和GOD,然后进行表面聚乙二醇化。纳米催化剂中的GOD可以催化葡萄糖耗竭,减少ATP的供应,进而下调HSP的表达,从而提高了低温热疗的效率。
研究进展:
采用温和共沉淀法将AQDs和GOD共包裹在CaCO3中。首先采用液相剥离法合成粒径均一的AQDs。为了使AQDs具有更好的生理分散性和稳定性,首先使其通过疏水作用和范德华力修饰1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺聚乙二醇(DSPE-PEG)。透射电镜(TEM)显示,聚乙二醇化的AQDs具有高分散性,平均直径为6.7 nm(图二a)。采用X射线光电子能谱(XPS)分析了AQDs的化学组成。XPS谱图(图二b)和特异性XPS谱图(图二c)证实了AQDs的O和Sb元素组成。此外,PEG化AQDs显示了从紫外(UV)到近红外范围内的广泛和浓度依赖性的吸收(图二d),证实了其PA成像和PTT性能。
接着,将pH敏感的CaCO3纳米颗粒作为载体,接着采用共沉淀法将AQDs和GOD共包封。简言之,将GOD和AQDs添加到含有Ca2+离子的乙醇溶液中,以确保GOD和AQDs被有效封装。然后加热使NH4HCO3分解产生的CO2和NH3气体,并不断扩散到乙醇溶液中,借此不断提供碳酸离子和碱性环境,触发G/A@ CaCO3 纳米催化剂的形成。得到的G/A@ CaCO3纳米催化剂被1,2-二油基-sn-甘油-3-磷酸(DOPA)、胆固醇和1,2-二十六烷基-sn-甘油-3-磷酸胆碱(DPPC)组成的脂质双层包覆,并进一步用DSPE-PEG修饰以提高生理稳定性。透射电镜观察到单纯的CaCO3呈均匀的球形分布,平均直径为108 nm(图二e)。对于G/A@CaCO3-PEG纳米颗粒,发现GOD和AQDs的负载对CaCO3结构的直径和形貌没有明显影响(图二f)。G/A@CaCO3-PEG NPs可以在水、磷酸盐缓冲盐水(PBS)和细胞培养基中很好地分散(图二g)。高角度环形暗场扫描透射电镜(HAADF-STEM)分析的元素映射(图二h)清楚地表明了C、O、Ca、Sb和N(存在于GOD中)在整个G/A@CaCO3-PEG纳米颗粒中的均匀分布。用Bradford蛋白分析法和电感耦合等离子体发射光谱仪(ICP-OES)分别计算出GOD和Sb的负载量分别为16.8% ± 1.9%和12.7% ± 2.6%(w/w)。由DLS数据可知(图二i),G/A@CaCO3-PEG和G/A@CaCO3的水动力直径分别为126 ± 6.3和114 ± 4.8 nm。这些结果证明G/A@CaCO3-PEG纳米催化剂的成功构建。
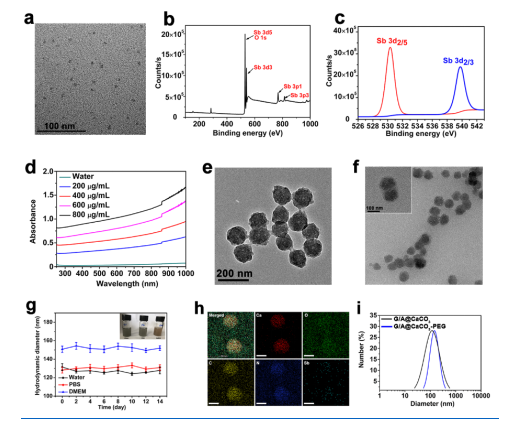
图二(a)聚乙二醇化AQDs的TEM图像和(b)XPS谱。(c)AQDs的Sb 3d特异性XPS光谱。(d)不同浓度的PEG修饰的AQDs的紫外吸收光谱。(e) CaCO3的TEM图像。(f)G/A@CaCO3-PEG的TEM图(插图为放大图像)。(g)G/A@CaCO3-PEG分散在不同介质(水、PBS、DMEM)中14天的照片及水动力粒径。(h)G/A@CaCO3-PEG元素分布图。(i)G/A@CaCO3及G/A@CaCO3-PEG的粒径分布。
已有研究表明,肿瘤的耐热性主要是由HSPs引起的,HSPs依赖于ATP的能量供应。因此,抑制ATP的产生有望克服肿瘤的耐热性。因此Western blot检测不同处理后的SW1990细胞中HSP(HSP70和HSP90)的表达情况。如图三a所示,近红外激光照射A@CaCO3-PEG处理后的细胞中HSP70和HSP90表达水平明显变高,这可能与防御性热休克反应有关。此外,GOD和G/A@CaCO3-PEG处理均显著降低了HSP70和HSP90的表达水平,证实了干扰ATP生成可以抑制HSP的过表达。同时对SW1990细胞不同处理后的HSP水平进行定量(图二b和c),发现A@CaCO3-PEG + NIR处理后,HSP70水平增加了1.44倍,而HSP90水平增加了1.12倍。而在G/A@CaCO3-PEG处理后,相对HSP70和HSP90水平显著降低至1.93和2.38倍。综上所述,G/A@CaCO3-PEG可通过下调HSPs的表达来增强基于AQDs PTT的活性。
G/A@CaCO3-PEG纳米催化剂引发的策略主要是利用GOD通过减少ATP的产生来抑制HSP的表达,从而增强AQDs的低温PTT效果。接着我们进一步评价G/A@CaCO3-PEG对SW1990肿瘤细胞的体外PTT作用。结果表明:细胞存活率依赖于G/A@CaCO3-PEG的剂量和激光功率密度(图二d和e)。在此基础上,我们利用0.8 W cm-2的近红外激光触发低温PTT。如图二f所示,A@CaCO3-PEG + 激光和G/A@CaCO3-PEG处理后细胞的相对存活率分别为71.4 ± 3.8%和62.4 ± 3.7%。这是由于单独使用低温PTT或GOD诱导的葡萄糖消耗作用相对较小,导致治疗效果不理想。此外,G/A@CaCO3-PEG经激光照射后,细胞活力明显下降至24.8 ± 4.7%。钙黄绿素-AM/PI双染色试验也证实G/A@CaCO3-PEG +激光处理后的表观细胞死亡高于其他处理(图二g)。流式细胞定量分析进一步验证了这些结果(图二h)。G/A@CaCO3-PEG在没有激光照射的情况下,由于GOD的饥饿效应导致中度细胞凋亡(61.3%)。而G/A@CaCO3-PEG + 激光治疗促进细胞凋亡/坏死最有效(70.7%)。这些结果表明,G/A@CaCO3-PEG联合激光照射可通过GOD介导的葡萄糖消耗抑制ATP的生成,从而诱导HSP下调,最后通过低温PTT诱导细胞死亡。
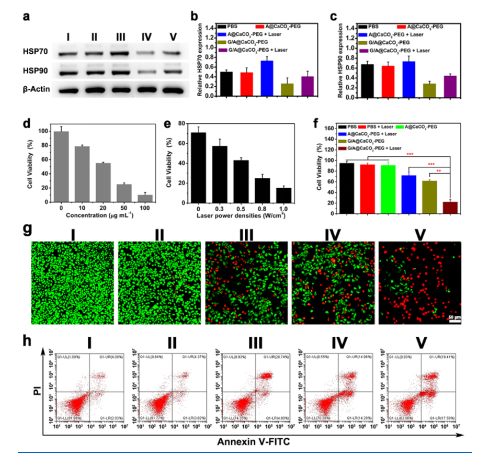
图 三(a-c)Western blotting分析SW1990细胞中HSPs的表达。(d)不同浓度G/A@CaCO3-PEG联合激光处理的细胞存活率。(e)细胞经G/A@CaCO3-PEG与不同功率密度激光照射后的存活率。(f)细胞经不同处理后的存活率。(g)不同治疗方式处理后的荧光图片。(h)流式细胞术分析凋亡情况。(Ⅰ)对照组,(Ⅱ) A@CaCO3-PEG,(Ⅲ)A@CaCO3-PEG + laser,(Ⅳ) G/A@CaCO3-PEG,(Ⅴ) G/A@CaCO3-PEG + laser。
最后,为评价体内治疗效果,将SW1990荷瘤小鼠随机分为5组(每组3只):1)生理盐水(对照),2)生理盐水+激光(laser),3)G/A@CaCO3-PEG, 4)A@CaCO3-PEG +激光(低温PTT),5)G/A@CaCO3-PEG +激光(协同治疗)。2、4、5组在注射后12 h,用0.8 W cm-2近红外激光照射5 min,触发低温PTT。在进行不同治疗模式后,每2天计算肿瘤体积(图四a)。结果发现:生理盐水处理组肿瘤快速生长明显,而单独激光照射没有明显的抑制作用。与此同时,单独使用G/A@CaCO3-PEG治疗在一定程度上抑制了肿瘤生长(抑制率:38.4%)。而对于A@CaCO3-PEG加激光照射治疗的小鼠,抑制率为45.5%。这些现象是由于GOD介导的葡萄糖消耗或单独低温PTT仅能产生较低疗效。相比之下,第5组(G/A@CaCO3-PEG +激光)处理后的小鼠的肿瘤生长受到有效抑制(抑制率为83.9%),这归因于GOD介导的饥饿治疗与低温PTT的协同作用。监测肿瘤重量(图四b)和相应的肿瘤照片(图四c)显著地证实了G/A@CaCO3-PEG纳米催化剂在激光照射下的治疗效果。H&E和脱氧核苷酸转移酶末端dUTP末端标记(TUNEL)染色结果显示G/A@CaCO3-PEG + 激光组细胞大面积收缩和核固缩最明显(图四d)。
为了阐明协同治疗组增强PTT疗效的潜在机制,我们通过免疫荧光染色分析检测肿瘤内HSP70(红色)和HSP90(绿色)的表达水平(图四e)。结果显示:热疗治疗(A@CaCO3-PEG + laser)后HSP90表达明显升高,而G/A@CaCO3-PEG治疗后HSP90表达显著下调,即使在激光照射后也是如此。通过量化各种治疗后的肿瘤内ATP水平,我们观察到G/A@CaCO3-PEG处理的小鼠,基于这一概念验证评估,很明显这种增强PTT的作用归因于GOD诱导的ATP供应限制介导的HSP抑制,可以有效逆转热疗治疗期间的热抵抗性。
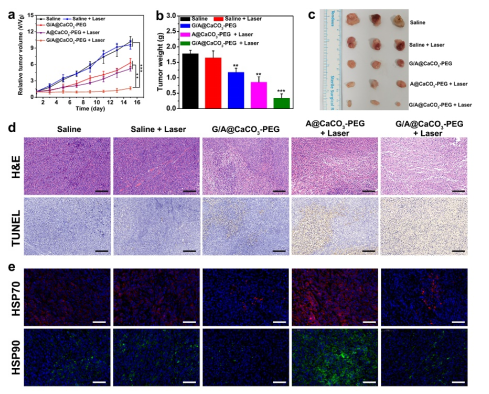
图四(a)SW1990荷瘤裸鼠经过不同的治疗手段后的相对肿瘤生长曲线(每组 5只) 。不同治疗模式后肿瘤重量(b)和代表性的离体肿瘤图片(c)。**P < 0.01, ***P < 0.001。(d)荷瘤裸鼠经过不同的治疗手段后肿瘤部位的H&E及TUNEL染色图。标尺为50 μm。(e)免疫荧光染色法检测不同处理后小鼠肿瘤中HSP70和HSP90的表达。标尺为50 μm。
总结与展望:
上海交通大学附属第六人民医院上海超声医学研究所(超声医学科)联合上海大学通过合理整合钙基生物矿物和单元素2D纳米材料,构建了一种高效的pH响应性纳米催化剂(G/A@CaCO3-PEG)。纳米催化剂通过“无抑制剂参与”策略克服了肿瘤的耐热性,从而提高了低温光热的治疗效率。将二维锑烯量子点和葡萄糖氧化酶加入可生物降解的CaCO3纳米颗粒中,制备了一种复合纳米催化剂。G/A@CaCO3-PEG一旦内化到肿瘤细胞中,会在微酸性的肿瘤微环境中迅速分解。随后,释放的GOD有效地耗尽了内源性葡萄糖,阻断了细胞的能量供应。GOD对ATP供应的限制也可以下调HSP的表达,从而逆转肿瘤细胞的耐热性。系统的体外和体内实验证实这种基于葡萄糖消耗和增强低温PTT的协同治疗模式可以获得显著的抗肿瘤性能,且没有明显的副作用。这项工作不仅拓展了pH响应的钙基纳米药物的生物医学应用,而且还为与热疗相关的纳米治疗中涉及肿瘤细胞的耐热性提供了一个有前景的策略。。
论文信息:
Biodegradable cascade nanocatalysts enable tumor-microenvironment remodeling for controllable CO release and targeted/synergistic cancer nanotherapy
Jianrong Wu, Xiaojun Cai,Gareth R.Williams,Zheying Meng,Weijuan Zou,Li Yao,Bing Hu,Yu Chen,Yuanyi Zheng
Bioactive Materials
DOI:10.1016/j.bioactmat.2021.08.018
原文链接:
https://www.sciencedirect.com/science/article/pii/S2452199X21003947