
可生物降解的级联纳米催化剂用于肿瘤微环境重构,实现可控的CO释放和肿瘤靶向/协同治疗
文章标题:Biodegradable cascade nanocatalysts enable tumor-microenvironment
remodeling for controllable CO release and targeted/synergistic cancer nanotherapy
第一作者:Jianrong Wu
通讯作者:Xiaojun Cai,Yu Chen, and Yuanyi Zheng
通讯单位:上海交通大学附属第六人民医院,上海大学
论文导读:
气体疗法作为一种新兴的肿瘤治疗方式,由于其低的毒副作用,具有广阔应用前景的治疗策略。然而这种治疗模式仍面临着诸多挑战,如治疗性气体的精确递送和可控释放。针对这一挑战,上海交通大学附属第六人民医院郑元义教授、蔡晓军副研究员和上海大学陈雨教授等合作报道了一种级联生物可降解纳米催化剂介导的原位持续释放CO气体和磁共振成像监测的靶向/协同肿瘤气体/饥饿纳米治疗的“肿瘤微环境重塑”策略。该纳米催化剂通过将葡萄糖氧化酶(GOD)和H2O2敏感分子羰基锰(MnCO)包裹在可生物降解的中空介孔有机硅纳米粒子中制备而成。GOD首先作为介孔氧化硅的“开关”,随后修饰靶向多肽(cRGD)用于特异性靶向αvβ3整合素过表达的肿瘤细胞。在肿瘤微酸性的情况下,GOD被解离,释放负载的MnCO前药。前药在H2O2的条件下原位释放CO气体。同时,GOD催化肿瘤细胞内葡萄糖分解产生葡萄糖酸和H2O2来重塑肿瘤微环境,进一步促进CO/Mn2+的原位生成。通过细胞实验和体内异位肿瘤模型验证表明:纳米催化剂通过协同CO气体和饥饿纳米治疗,可以获得了优越的治疗性能。本研究为通过重塑肿瘤微环境增强CO介导的抗肿瘤疗效提供了一种新的策略。
研究进展:
在这项工作中,研究人员设计了一种智能的靶向/级联纳米催化剂(RGD-GOD-MnCO@HMONs,缩写为RG-Mn@H) 重构TME,实现CO气体的原位可控释放。构建的级联纳米催化剂可在磁共振(MR)引导下用于协同肿瘤饥饿治疗与CO气体治疗(图一)。在TME中,通过GSH诱导的二硫键断裂和pH诱导的亚胺键水解打开GOD门卫,继而使得HMONs的快速生物降解,导致负载MnCO的释放,MnCO进一步与内源性H2O2和H+反应以实现CO气体的按需释放。随后,释放的GOD催化葡萄糖生成葡萄糖酸和H2O2。这一过程不仅切断了细胞的营养来源,而且通过H+和H2O2富集的TME的重构,加速了MnCO的分解,提高了CO的生成。同时,基于释放出的顺磁性Mn2+离子,磁共振T1加权成像也可以监测治疗过程。该方法在体外和体内都得到了系统的评价和验证。
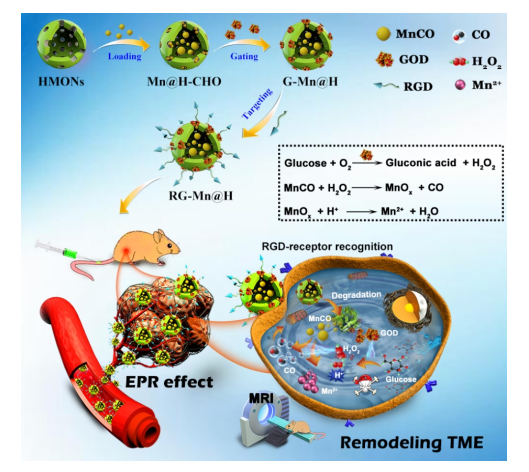
图一 靶向级联纳米催化剂(RG-Mn@H)的设计及其用于TME的重构,引发连续级联反应的示意图
首先,该团队采用“氨水辅助选择性蚀刻”方法合成具有二硫键掺杂/结合的HMON框架。通常,核/壳SiO2@MONs在三乙醇胺存在下制备。用氨水溶液选择性地刻蚀SiO2核,形成空心纳米结构。透射电子显微镜(TEM)图像显示,获得的HMON具有均匀的空心球形拓扑结构,粒径约为55 nm(图二a)。相应的能谱分析显示了C、S、Si和O元素的分布。基于29Si魔角自旋(MAS)和13C交叉极化MAS(CPMAS)固态NMR谱的HMONs组成分析证实HMONs中存在二硫键杂化的倍半硅氧烷骨架(图二b和c),当MnCO封装后,HMONs-CHO的Zeta电位变为-16.2 mV(图二d)。从Mn@H-CHO的紫外-可见光谱可以看出(图二e),在340 nm处发现MnCO的显著吸收,证实了有效的MnCO封装,其负载效率为37.5%(w/w%)。GOD作为门控开放,通过形成pH敏感的亚胺共价键与HMONs-CHO结合,从而得到一种新的纳米催化剂,GOD-MnCO@HMONs (G-Mn@H). 同时,进一步修饰RGD形成最终产物RG-Mn@H 纳米催化剂。TEM图像(图二f)显示了RG-Mn@H独特的球形结构,且平均直径为66.8 nm,略大于原始的HMONs。元素映射图像也反映了RG-Mn@H 中Si、C、S、O、N和Mn元素的均匀分布(图二g)。HMONs-CHO的BET比表面积和孔径在经过药物加载、随后的GOD修饰和RGD连接后表现出明显的减小。逐步改变的Zeta电位进一步证明了RG-Mn@H的成功合成(图二d)。
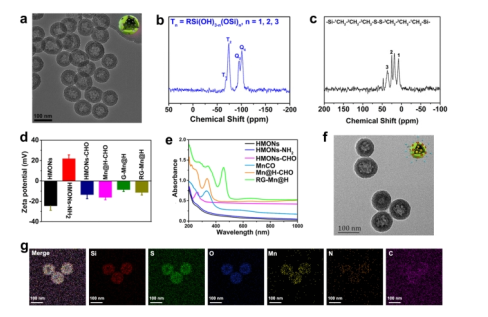
图二 RG-Mn@H 纳米催化剂的表征。(a)HMONs纳米粒子的TEM图像。(b)HMONs的29Si和(c)13C谱。(d)HMONs,HMONs-NH2,HMONs-CHO的zeta电位和(e)紫外-可见吸收光谱。RG-Mn@H的(f)TEM图像和(g)硅、硫、氧、锰、碳、氮的元素映射mapping图。
进一步评估RG-Mn@H对TME的重构能力及体外疗效。为了深入了解其细胞内吞行为,选择αvβ3过表达的肿瘤细胞系MDA-MB-231来评估纳米催化剂的细胞摄取效率。从激光共聚焦扫描显微镜(CLSM)图像中,RG-Mn@H 与G-Mn@H 组观察到异硫氰酸荧光素(FITC)荧光信号的增加(图三a)。另外,当用游离RGD预处理后再与细胞孵育时,荧光强度相应地降低,证明了RG-Mn@H的靶向性主要归因于表面连接的RGD与αvβ3整合素蛋白的特异性识别。流式细胞术定量进一步证实,通过RGD修饰,这些纳米颗粒的细胞内化显著增加(图三b)。结果证明:纳米催化剂良好的细胞内吞作用有助于肿瘤靶向的MnCO转运。接着检测不同处理后MDA-MB-231细胞内H2O2水平(图三c)。与PBS和G-Mn@H 治疗组相比,RG-Mn@H 处理后的细胞内的H2O2随着时间的延长迅速增加。RG-Mn@H组处理后的细胞内H2O2水平(1.14 mM)比GOD组(0.82 mM)高出约1.5倍。接下来,进一步应用经典的CO荧光探针(COP-1)来评估细胞内H2O2驱动的CO释放。CLSM图像显示,R-Mn@H组未检测到明显的绿色荧光,而RG-Mn@H组在pH 5.0下,细胞内的荧光强度随培养时间的延长而显著增强,表明细胞内CO的可控释放(图三d)。RG-Mn@H在pH 7.4条件下处理的肿瘤细胞只有微弱的荧光信号,这可归因于稳定的纳米催化剂和中性pH条件下GOD出于关状态。因此,通过重构TME实现H2O2的自供给来控制CO的释放速率和释放量是可行的。然后我们进一步检查RG-Mn@H的体外治疗效果(图三e)。在没有葡萄糖的环境下,不同纳米材料培养的MDA-MB-231癌细胞的存活率与对照组接近。相对而言,通过RG-Mn@H与葡萄糖进行治疗,细胞死亡率显著(86.8%)。这一结果表明,葡萄糖是达到预期治疗效果所必需的。同时发现RGD修饰的纳米催化剂可以增强对癌细胞的细胞毒性,这是由于主动靶向效应αvβ3-RGD的特定识别。同时,细胞毒性与RG-Mn@H的浓度以及pH值密切相关。此外,钙黄绿素-AM/PI染色试验进一步验证治疗效果(图三f)。
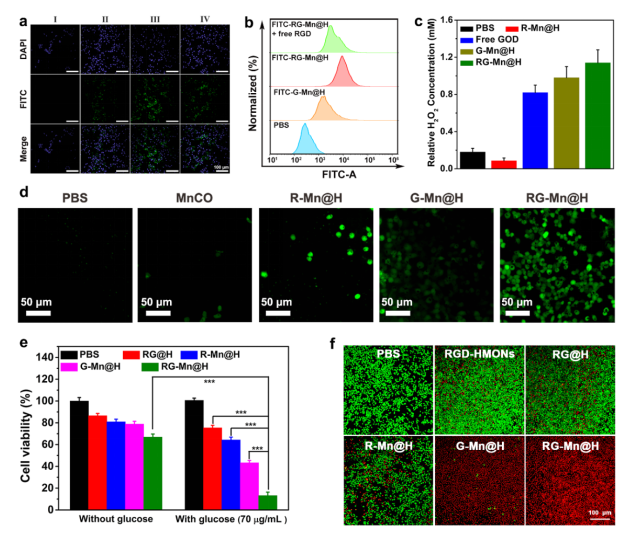
图 三 (a)不同处理后MDA-MB-231细胞的共焦荧光图像。所有比例尺都是50 µm。Ⅰ: PBS;Ⅱ: FITC-G-Mn@H (20 µg/mL);Ⅲ: FITC-RG-Mn@H (20 µg/mL);Ⅳ: FITC-RG-Mn@H (20 µg/mL)+ 游离RGD;(b)不同处理后MDA-MB-231细胞的流式细胞术分析;(b, c)不同处理后MDA-MB-231细胞内H2O2含量的变化。(d)用COP-1型CO荧光探针检测细胞内CO含量([Mn]:10µg/mL)。(e)不同处理后MDA-MB-231细胞相对存活率([Mn]:10 µg/mL)(f)不同处理后钙黄绿素-AM和PI共染细胞的共聚焦图像。
最后,研究人员对采用MDA-MB-231乳腺癌模型进行评价RG-Mn@H的肿瘤治疗效果。小鼠随机分为五组:PBS组,RG@H,R-Mn@H,G-Mn@H,和RG-Mn@H。 在整个治疗期间监测肿瘤体积和体重。如图四a所示,采用RG@H治疗对肿瘤生长无明显抑制作用(抑制率为28.6%)。而单独使用R-Mn@H的小鼠也仅仅得到一定的静置(抑制率35.5%)。相比之下,G-Mn@H 治疗抑制效果更为显著(抑制率66.7%)。最显著的应该是协同纳米治疗组(RG-Mn@H),其在治疗期间有显著的抑瘤作用(抑瘤率94.3%)。通过测定各组代表性小鼠的肿瘤重量和相应的数码照片进一步证实RG-Mn@H获得了佳治疗效果(图四b)。与此同时,不同治疗组的小鼠体重没有明显变化(图四c),表明所有制剂引起的副作用可以忽略不计。值得注意的是,在注射后30分钟,小鼠的血糖水平略有下降,然后自发恢复正常,而在后续治疗过程中观察到血糖水平没有明显变化(图四d)。这一结果进一步表明RG-Mn@H不会引发潜在毒性。值得注意的是,RG-Mn@H治疗组的小鼠存活率明显长于其他治疗组(图四e),进一步证明了高协同抗癌作用。为了揭示其抗肿瘤作用的生物学机制,采用苏木精和伊红(H&E)、TdT介导的dUTP生物素缺口标记(TUNEL)和Ki-67抗体对各种治疗后的肿瘤切片进行染色(图四f)。可见,RG-Mn@H处理的老鼠组,在H&E染色图像上显示最明显的凋亡/坏死区,而TUNEL染色显示肿瘤细胞凋亡水平最高。同样地,Ki-67染色显示肿瘤细胞的增殖抑制最明显。
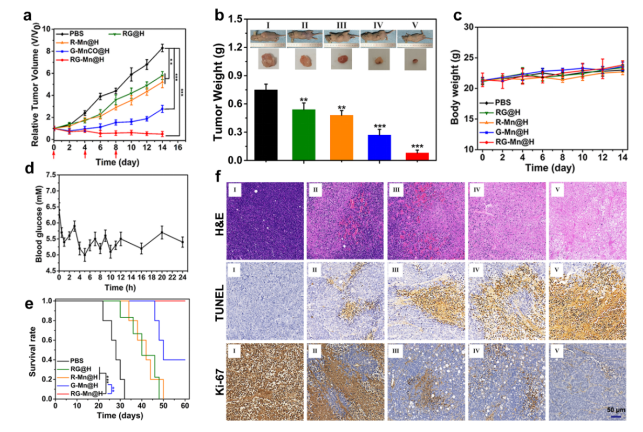
图四 RG-Mn@H 纳米催化剂的体内抗肿瘤效果。(a)不同治疗模式在治疗期间的肿瘤生长曲线( n= 5)。(b)治疗后第14天小鼠肿瘤重量。**P < 0.01,***P < 0.001。插图:MDA-MB-231荷瘤小鼠的代表性照片和不同治疗后小鼠切除肿瘤的相应图像。Ⅰ:PBS;Ⅱ:RG@H; Ⅲ:R-Mn@H;Ⅳ:G-Mn@H;Ⅴ:RG-Mn@H。(c)治疗期间小鼠体重变化(n = 5)。(d) 小鼠静脉注射RG-Mn@H后的血糖水平(n = 5)。(e)不同治疗组后MDA-MB-231荷瘤小鼠2个月生存曲线(n = 5)。(f)MDA-MB-231 荷瘤裸鼠经过不同的治疗手段后肿瘤部位的 H&E、TUNEL和Ki67染色图。比例尺:50 μm。
总结与展望:
上海交通大学附属第六人民医院上海超声医学研究所(超声医学科)联合上海大学报告了一种靶向/级联纳米催化剂实现原位可控CO释放和有效气体治疗的“TME重构”。作为一个范例,类似芬顿的前药MnCO和天然GOD被同时整合到可生物降解的HMONs中来构建RG-Mn@H纳米催化剂。RG-Mn@H能够特异性响应TME并随后重构TME。当被肿瘤细胞内吞时,RG-Mn@H 发生快速的生物降解同时打开GOD门控开关。随后,GOD引起的内源性葡萄糖消耗的级联反应不仅对肿瘤细胞的饥饿治疗有显著的作用,而且还通过提高H2O2水平来重构TME。RGD修饰的纳米催化剂具有良好的生物相容性、固有的肿瘤特异性生物降解性和协同抗癌作用,为αvβ3整合素高表达的恶性肿瘤的靶向、高效气体治疗提供了一种新的思路。同时作为智能纳米平台的例子,RG-Mn@H具有重构TME以增强纳米治疗效果的特定能力。
论文信息:
Biodegradable cascade nanocatalysts enable tumor-microenvironment remodeling for controllable CO release and targeted/synergistic cancer nanotherapy
JianrongWu,ZheyingMeng,AgataA.Exner,XiaojunCai,XueXie,BingHu,YuChen,YuanyiZheng,
Biomaterials
DOI:10.1016/j.biomaterials.2021.121001
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961221003574