
文章标题:Self-synergistic effect of Prussian blue nanoparticles for cancer therapy: driving photothermal therapy and reducing hyperthermia-induced side effects
第一作者:Xue Xie, Wei Gao
通讯作者:Yuanyi Zheng, Xiaojun Cai, Jianrong Wu
通讯单位:上海交通大学附属第六人民医院上海超声医学研究所(超声医学科)
论文导读:
光热疗法(PTT)因其具有非侵袭性、深层组织渗透和时空选择性的治疗优势在癌症治疗领域引起了广泛关注。然而,在光热治疗期间活性氧物质的过度产生可能对肿瘤周边的健康组织造成不可逆的损伤。同时,光热治疗激发炎症反应,从而可能引起肿瘤的复发及转移。因此,开发有效的策略来减少光热治疗的不良反应,对光热疗法的进一步发展至关重要。于此,上海市第六人民医院超声医学科郑元义教授课题组提出了一种“纳米材料的自协同效应”新概念,即单组分纳米材料利用其自身内在特性来增强治疗的正向作用,同时降低治疗的副作用。在这项研究中,作者使用普鲁士蓝纳米粒作为示例讨论了“纳米材料的自协同效应”,所设计的普鲁士蓝纳米粒具有良好的光热转化性能、活性氧清除特性和抗炎特性,克服了光热治疗期间炎症反应和热应激诱导的活性氧的问题。普鲁士蓝纳米粒的自协同效应促进了其进一步向临床转化的应用发展。“纳米材料的自协同效应”新概念的提出能激发研究者们探索和利用材料自身的内在特性打开癌症或其他疾病治疗的新途径。
研究进展:
在光热治疗中,光热杀死癌细胞的同时诱导炎性因子的释放可能激活残留癌细胞的促生存基因,以及热扩散过程中产生的过量活性氧(ROS)将损伤周围健康组织的不良反应是光热治疗往临床进一步发展急需解决的问题。目前已报道的研究是将具有光热材料与抗炎或清除ROS的材料复合在一起达到光热治疗和抗炎或/和清除ROS的功能。然而,这些多组分体系涉及复杂的合成过程和高昂的成本。更重要的是,很少有研究同时关注光热治疗期间的抗炎和清除过量ROS。基于此,该研究团队以普鲁士蓝纳米粒(PBs)为例,提出并讨论了“纳米材料的自协同效应”的概念(图1)。PBs具有良好的光热转化性能、清除ROS和抗炎作用。其固有的ROS清除特性可防止因PTT相关的热应激而产生过量ROS。同时,静脉注射的PBs通过其固有的抗炎特性下调炎性细胞因子的释放。该策略克服了PTT过程中的炎症反应和热应激诱导的ROS问题,从而达到光热治疗/减轻其副反应的癌症高效光热治疗模式。
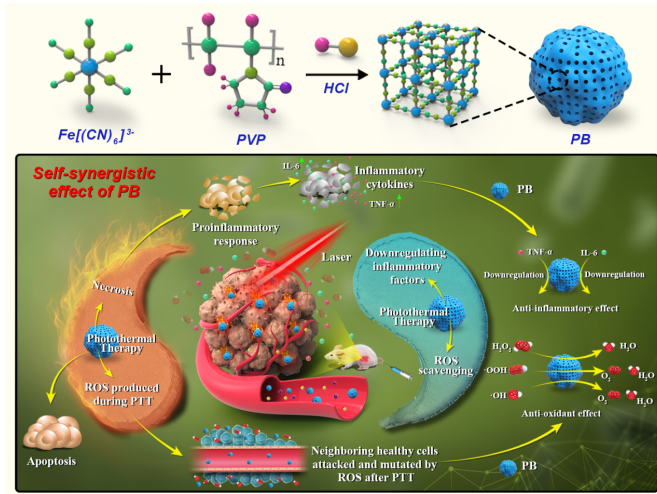
图一 普鲁士蓝纳米粒的自协同效应示意图
首先,该团队通过水热合成法合成普鲁士蓝纳米粒(PBs),PBs具有类圆形形貌、均匀的尺寸和良好的分散性(图2 a-b),其平均流体动力学粒径约为110 nm(图2 c)。PBs的近红外吸收光谱显示在700 nm处有较宽的吸收峰(图2 d),光热升温曲线显示随着PBs溶液浓度增加温度也逐渐升高(图2 e),表明所制备的PBs具有良好的光热转换性能。在日常长期储存中,PBs在水和生理盐水中粒径无明显变化,PBs在水和生理盐水中分散良好,能够长时间保存(图2 f)。体外实验结果显示PBs清除•OOH、H2O2和•OH的能力呈PBs浓度依赖性,PBs具有类SOD、CAT活性以及·OH等自由基清除能力(图2 g-i)。
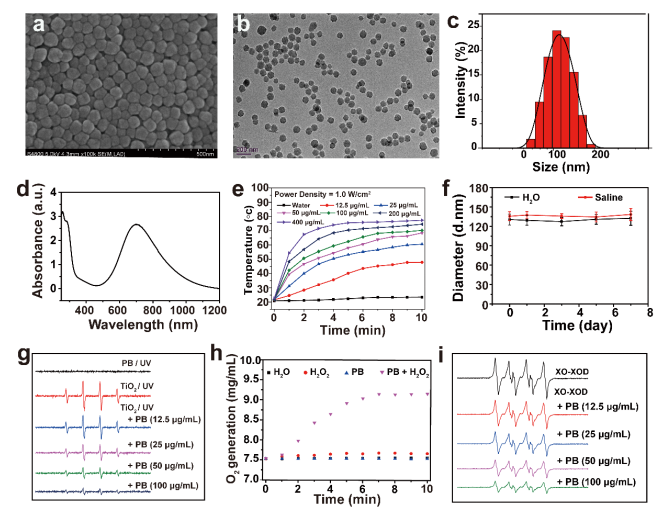
图二 普鲁士蓝纳米粒的体外表征、性能测试
随后,研究人员通过诱导小鼠炎症模型来研究PBs在调节炎症和氧化应激中的作用。与炎症组(阳性对照)相比,PBs处理后的ALT和AST水平显著降低,这表明PBs具有保护肝细胞免受损伤的能力(图3a, b)。此外,相对于炎症组肝脏和脾脏ROS升高,PBs处理组ROS水平与对照组相似 (图3c-f)。通过TUNEL染色及其定量分析显示在不同治疗后PBs可以减少炎症因子以及降低ROS水平(图3h-j)。
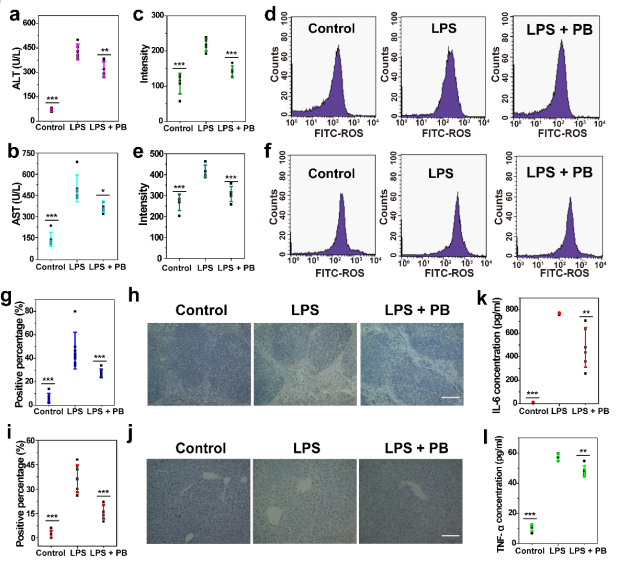
图三 普鲁士蓝纳米粒对ROS和炎性细胞因子的清除作用
最后,在小鼠乳腺癌体内治疗实验中,各组肿瘤区域光热升温曲线(图4a)、肿瘤生长曲线(图4b)、H&E和Ki-67染色(图4e)表明,PBs在808 nm近红外激光照射下达到了良好的肿瘤光热治疗效果,静脉注射PBs可下调血清中炎性细胞因子IL-6和TNF-α的表达(图4c, d)。
PTT中PBs对癌症的自协同效应有效地解决了PTT期间炎症反应和热应激诱导的ROS的问题,这是由于其光热转换、清除ROS和抗炎症的三个内在特性,从而增强PTT的效果并减少副作用(炎症反应和热应激诱导的ROS)(图4f)。
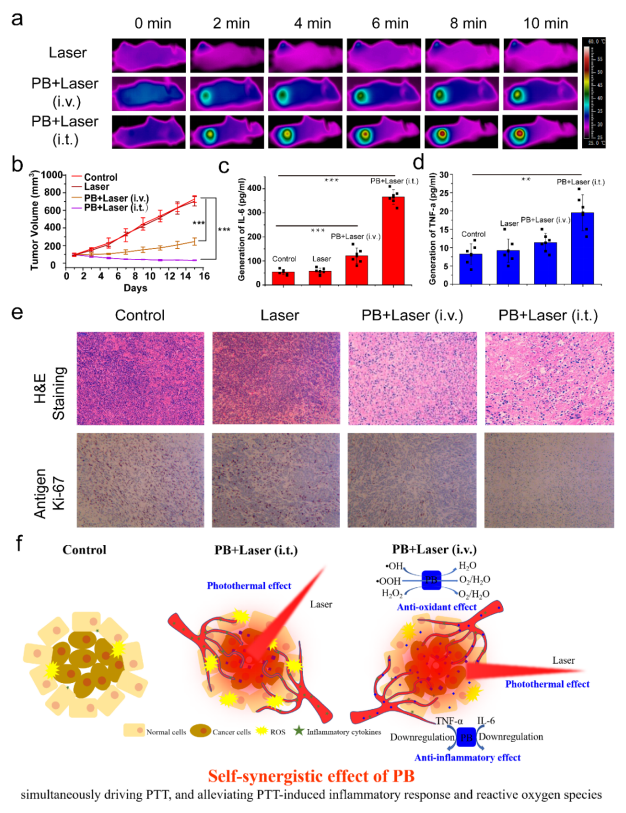
图四 体内异种移植瘤模型高效光热治疗
总结与展望:
上海交通大学附属第六人民医院上海超声医学研究所(超声医学科)团队针对光热治疗中炎症以及过量ROS产生引起副反应的问题,提出了“纳米材料自协同效应”的概念,并以普鲁士蓝纳米粒(PBs)为例阐述了其在肿瘤治疗中的应用。PBs的这种内在性能可以实现高效PTT,同时可以减少PBs介导的PTT的副作用,这一有效的策略结合了光热-抗氧化和光热-抗炎策略,解决了光热疗法向临床发展中的瓶颈问题。PBs自身协同作用的发现促进了其进一步的临床转化。更重要的是,“纳米材料的自协同效应”的概念可能对进一步探索材料的内在属性,以增强其积极作用和/或减少副作用的未来发展方向提供一个新的视角,促进纳米药物的转化,并真正能发挥出在临床实践指导的作用。
论文信息:
Self-Synergistic Effect of Prussian Blue Nanoparticles for Cancer Therapy: Driving Photothermal Therapy and Reducing Hyperthermia-induced Side Effects
Xue Xie#, Wei Gao#, Junnian Hao, Jianrong Wu*, Xiaojun Cai*, Yuanyi Zheng*
J Nanobiotechnology
10.1186/s12951-021-00819-2
原文链接:
https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-021-00819-2