
用于实体肿瘤内的纳米颗粒富集进而增效抗肿瘤治疗——超声联合仿病毒表面拓扑结构的给药策略
文章标题:Marriage of Virus-Mimic Surface Topology and Microbubble-Assisted Ultrasound for Enhanced Intratumor
Accumulation and Improved Cancer Theranostics
第一作者:Zheying Meng, Yang Zhang, E Shen
通讯作者:Wenkun Bai,* Bing Hu,* Wenxing Wang,* and Yuanyi Zheng
DOI:https://doi.org/10.1002/advs.202004670
论文导读:
纳米颗粒在实体肿瘤内的低递送效率导致治疗效果降低和副作用加重是纳米治疗剂临床转化的关键难题。最近的Meta分析表明,2015年-2018年的新近研究与2005年-2015年的所有研究相比,纳米颗粒的实体肿瘤递送效率并没有统计学意义的改善。上海交通大学附属第六人民医院郑元义课题组联合复旦大学化学院王文兴课题组针对这一关键科学问题进行了探讨,通过优化纳米颗粒表面结构为仿病毒结构,以增强纳米颗粒表面粗糙程度、促进肿瘤细胞的摄取;同时联合使用微泡辅助低频超声(MAUS)作为被动靶向手段,提高生物屏障的通透性,显著提高纳米颗粒在实体肿瘤的递送和渗透。这项策略在前列腺癌的平均递送效率达6.84%,显著高于目前报道的最高水平1.42%。
研究进展:
微泡辅助低频超声(microbubble-assisted low-frequency ultrasound,MAUS)技术具备安全、非侵入性的优势,利用超声激发微泡产生的声空化效应能够一过性提高生物膜(如血管内皮和细胞膜)的渗透性。MAUS已被用于增强基因或药物在众多疾病模型的靶向递送,如脑卒中、心血管疾病和肿瘤。然而,纳米颗粒作为治疗剂本身或作为基因及药物的载体,目前在实体肿瘤的递送效率极低,如在前列腺癌的递送效率最高的记录仅为1.42%。MAUS是否能够提高纳米颗粒在实体肿瘤的富集具有探索价值。该研究使用了500 kHz的低频超声,而不是大多数当前研究中大多采用的1 MHz超声。众所周知,低频超声具有较高的组织穿透力的优势,这可以进一步促进纳米粒子在深部肿瘤中的递送。此外,低频超声具备更低的声压阈值,更容易触发声空化效应,有助于一过性提高生物膜的渗透性。
从纳米颗粒的固有性质的角度来看,当纳米粒子具有相似的表面积、电荷和表面涂层时,表面拓扑结构可能会严重影响纳米颗粒的外渗能力。表面粗糙度可以大大增加“纳米颗粒-生物界面"相互作用的表面积,降低相互排斥作用,从而促进粘附和细胞吞噬。
因此,研究者假设仿病毒粗糙表面拓扑结构的纳米颗粒可以增加的纳米颗粒-生物屏障界面的相互作用。最终该研究成功采用单胶束外延生长的方法制备了多功能的纳米颗粒,即仿病毒结构的二氧化硅包裹内部磁性Fe3O4的特殊核壳结构纳米颗粒MVSN-IR825,其制备过程步骤示意图如图1A。MVSN-IR825的TEM图像(1B), SEM图像(1C, 1D), 尺寸分布(1E)和紫外-可见-近红外吸收光谱(1F)如图1所示。同时合成了光滑表面、介孔表面的MSSN-IR825、MMSN-IR825作为对照,三种粒径大致相仿、IR825接枝率大致相同。
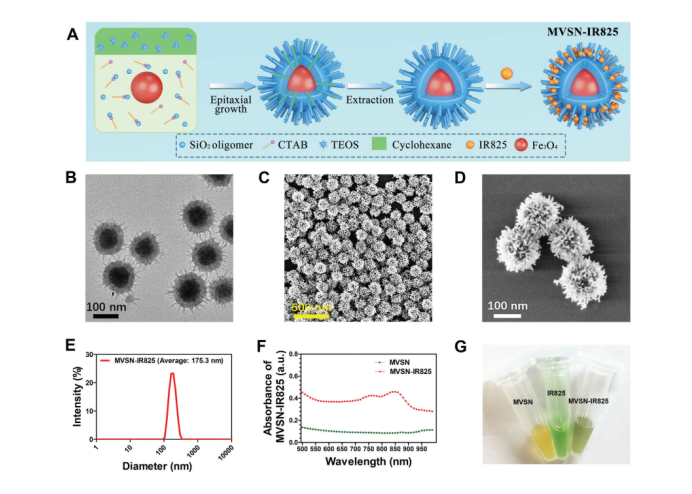
图1 MVSN-IR828的制备和表征
随后通过细胞摄取实验证实,与MSSN-IR825、MMSN-IR825相比,MVSN-IR825具有更高的细胞摄取率;MAUS可以进一步增加前列腺癌细胞摄取。如图2所示,细胞核呈现DAPI染色后的紫色荧光,纳米颗粒呈现FITC标记后的绿色荧光,在相同的孵育时间内,MVSN-IR825组显示出比MSSN-IR825和MMSN-IR825更多细胞内绿色荧光。除此之外,流式细胞术检测结果(图2B 2D)也表明,MVSN-IR825组比MSSN-IR825组和MMSN-IR825组显示出更有效的细胞内化;MAUS可以进一步增加前列腺癌细胞摄取。
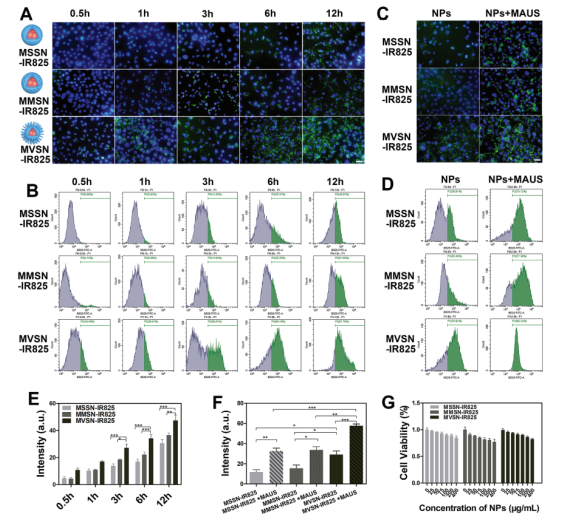
图2 细胞摄取实验
基于细胞水平实验已证实了仿病毒结构纳米颗粒联合MAUS可以增加前列腺癌细胞摄取纳米颗粒,随后研究进一步在体内实验进行验证。为了比较不同表面结构纳米颗粒、联合使用MAUS是否促进纳米颗粒在实体肿瘤内的富集,改研究建立PC-3皮下移植瘤、PC-3原位瘤的模型,使用多种成像模式包括PAI、FI in vivo、MRI进行验证(如图3),由于MVSN-IR825纳米颗粒因为IR825的存在,可以进行PAI、FI in vivo;由于内部含有Fe3O4核,可以进行MRI的T2加权成像,因此本章在PAI、FI in vivo、MRI多种模态成像下验证了MVSN-IR825优于MSSN-IR825、MMSN-IR825的肿瘤内富集效果,以及联合使用MAUS后实体瘤内的纳米颗粒富集进一步增加。
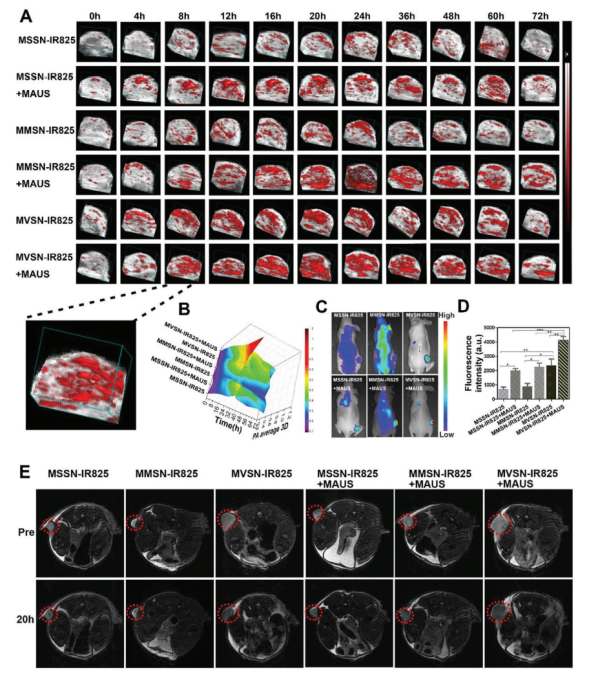
图3 多种成像方法监测PC-3异种移植荷瘤小鼠中纳米颗粒的富集
随后进一步从组织学水平进行普鲁士蓝染色显示铁沉积和分布进一步证实了MVSN-IR825联合MAUS可以促进纳米颗粒突破肿瘤血管、提高纳米颗粒在深部肿瘤间质的渗透(如图4 A)。定量的ICP分析结果表明MVSN-IR825联合MAUS可使纳米颗粒的肿瘤递送效率提高至6.82%,远高于目前研究报道前列腺癌纳米颗粒富集的最大递送效率1.42%(如图4 B)。同时影像学结果以及ICP的多个时间点监测结果表明了尾静脉注射20小时后实体瘤内富集达到高峰,这为后续在体抗肿瘤治疗研究提供了最有效治疗时间点。MVSN-IR825因为内部Fe3O4核而具备类过氧化氢酶活性,可与H2O2反应产生氧气。这为后续MVSN-IR825的光动力和声动力治疗提供了重要保证(如图4 C, 4 D, 4 E)。
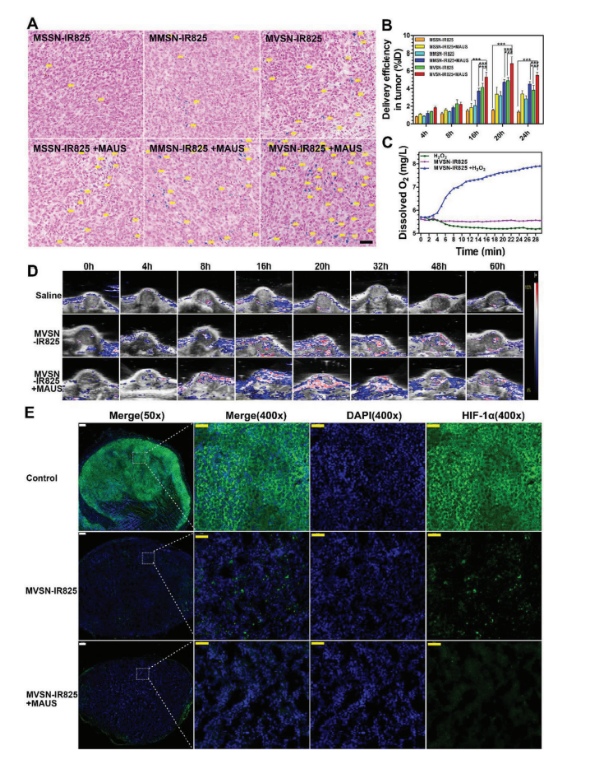
图4 肿瘤内纳米颗粒的富集以及肿瘤乏氧状态的改善
然后研究从体外水平探索了MVSN-IR825的光热、光动力、声动力多模式抗肿瘤治疗的能力。首先MVSN-IR825具备良好、稳定的光热转换能力(图5 A, 5 B)。其次,体外ESR检测活性氧产生的实验证实了MVSN-IR825可在激光和超声的辐照下产生单线态氧,尤其在氧气辅助下可明显提高单线态氧的产生(图5 C, D)。细胞水平DCFH-DA染色进一步验证了激光和超声辐照下细胞内活性氧的产生;而激光和超声的联合辐照可进一步提高细胞内活性氧水平(图5 G)。CCK-8实验和活死染色进一步证实了激光和超声联合辐照具有最佳的前列腺癌细胞治疗效果,激光辐照和超声辐照使用的先后顺序对抗前列腺癌细胞治疗效果没有明显差异(图5 H)。因此,细胞水平证实了激光辐照细胞时可通过光热和光动力两种方式杀伤前列腺癌细胞。
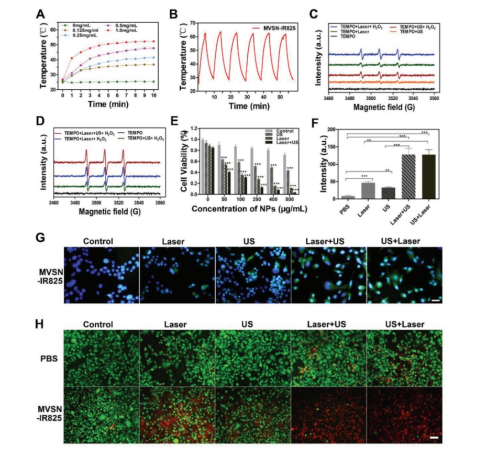
图5 MVSN-IR825体外的抗肿瘤治疗
基于前期实验结果,研究采用MVSN-IR825联合MAUS尾静脉给药20小时后开始治疗的方案,激光辐照皮下瘤、原位瘤均得到明显的升温表明MVSN-IR825在实体瘤内的有效富集。超声造影(图6 A)、生物发光成像(图6 B)结果表明单独激光或超声辐照可部分抑制肿瘤活性,但是激光和超声联合辐照可完全抑制肿瘤活性。同时DHE染色结果(图6 C)表明激光和超声辐照的皮下瘤和原位瘤组织内产生活性氧,并且激光和超声联合辐照后活性氧产生更多,表明实体瘤内富集的MVSN-IR825可通过光动力治疗、声动力治疗抑制前列腺癌实体瘤。此外,Ki67染色和Tunel染色结果(图6 D)也反映了组织学水平抗肿瘤治疗的有效性。肿瘤大小的监测结果(图6 E)表明单独激光辐照、单独超声辐照可在一定程度抑制前列腺癌实体瘤的生长,但是存在残余肿瘤继续生长的现象;激光和超声联合辐照皮下瘤和原位瘤,可完全抑制肿瘤。该研究从在体水平论证了近红外激光和低频超声联合辐照MVSN-IR825可通过光热、光动力、声动力三种模式完全抑制前列腺癌实体瘤。
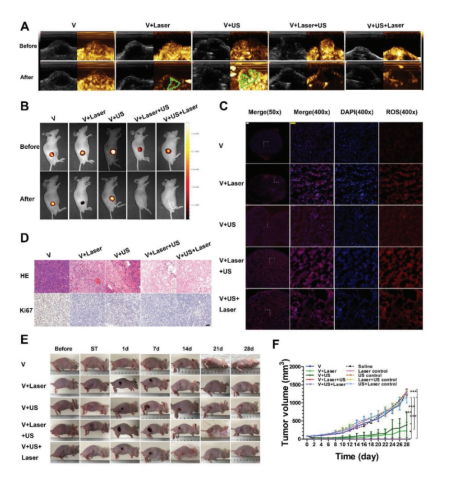
图6 PC-3皮下荷瘤小鼠的体内治疗效果
总结与展望:
上海交通大学附属第六人民医院上海超声医学研究所(超声医学科)联合复旦大学化学院王文兴课题组针对纳米颗粒在肿瘤内靶向效果差、富集少的关键科学问题,本研究从纳米颗粒自身表面结构优化的角度合成了仿病毒结构的纳米颗粒MVSN-IR825,同时合成了另外两种不同表面结构纳米颗粒MSSN-IR825、MMSN-IR825作为对照;从外源性被动靶向技术的角度引入了MAUS的辅助。通过优化纳米颗粒为仿病毒结构以增强纳米粒表面粗糙程度;联合使用微泡辅助低频超声(MAUS)作为被动靶向手段,提高生物屏障的通透性,提高纳米颗粒在实体前列腺肿瘤的富集。最终研究制备仿病毒结构的多功能纳米颗粒MVSN-IR825,研究主要使用PC-3异种肿瘤进行深度研究。为了进一步证实此项策略的有效性,该研究在体外AGS胃癌细胞和143B骨肉瘤细胞,以及在体内PC-3原位肿瘤和143B异种肿瘤进行进一步验证。这项工作从体外、细胞、动物多水平,通过影像学、组织学、多种动物模型等多种方法清楚地证明 “内在+外在优势”策略极大地改善了纳米粒子在肿瘤内的渗透和分布,增强了癌症的治疗效果。本研究设计的诊疗一体化的纳米颗粒为探索前列腺癌的临床诊疗方向提供依据,同时也为肿瘤纳米医学中的关键瓶颈问题提供了新的解决思路。
论文信息:
Marriage of Virus-mimic Surface Topology and Microbubble-assisted Ultrasound for Enhanced Intratumor Accumulation and Improved Cancer Theranostics
Zheying Meng, Yang Zhang, E Shen, Wei Li, Yanjie Wang, Krishnan Sathiyamoorthy, Wei Gao, Michael C. Kolios, Wenkun Bai*, Bing Hu*, Wenxing Wang*, Yuanyi Zheng*
Advanced Science
DOI: 10.1002/advs.202004670
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202004670